Corrosão Galvânica entre Metais Diferentes
Corrosão Galvânica entre Metais Diferentes
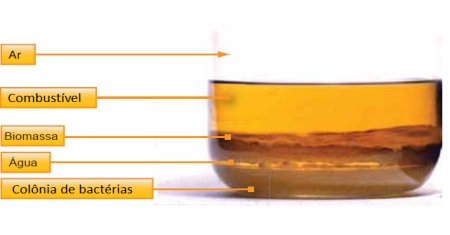
Quando dois metais diferentes entram em contato na presença de um condutor, como um eletrólito, pode ocorrer uma reação eletroquímica conhecida como corrosão galvânica. Essa corrosão ocorre porque os dois metais possuem diferentes potenciais eletroquímicos, criando uma célula galvânica. O metal menos nobre (ânodo) se corroerá, enquanto o metal mais nobre (cátodo) será protegido.
Mecanismo de Formação:
- O eletrólito, geralmente água com íons dissolvidos, age como meio condutor.
- O contato direto ou a proximidade permite a transferência de elétrons entre os metais.
- O metal menos nobre perde elétrons, iniciando sua oxidação, enquanto o mais nobre reduz os íons presentes no eletrólito.
Danos Potenciais:
- A corrosão galvânica muitas vezes começa de forma invisível e pode causar danos significativos ao longo do tempo.
- Pode criar cavidades microscópicas e enfraquecer a estrutura dos componentes envolvidos.
- É particularmente perigosa em sistemas críticos, pois o dano ocorre frequentemente fora do alcance da inspeção visual regular.
Prevenção e Controle:
- Isolamento: Inserir barreiras dielétricas (não condutivas) entre os metais para evitar contato direto.
- Seleção de Materiais: Combinar metais com potenciais galvânicos similares para minimizar a diferença eletroquímica.
- Proteção Catódica: Utilizar ânodos de sacrifício para proteger os metais estruturais mais importantes.
- Revestimentos: Aplicar revestimentos protetores, como tintas ou tratamentos anodizantes, para proteger superfícies metálicas.
- Inspeção Regular: Executar desmontagem e inspeção periódica para identificar e mitigar sinais iniciais de corrosão.
A corrosão galvânica é um fenômeno amplamente estudado devido aos seus impactos em estruturas aeronáuticas, que operam em ambientes propensos à exposição à umidade e contaminantes. A detecção precoce é essencial para prevenir falhas estruturais que podem comprometer a segurança da aeronave.